LEY DE BOYLE: Fue descubierta por Robert Boyle en 1662. Edme Mariotte también llegó a la misma conclusión que Boyle, pero no publicó sus trabajos hasta 1676. Esta es la razón por la que en muchos libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte.
Se ha comprobado experimentalmente que el volumen de una determinada cantidad de gas ideal, cuando la temperatura se mantiene constante, es inversamente proporcional a la presión que se ejerce sobre el gas.
pxv=k
LEY DE CHARLES: Cuando un gas se calienta a presión y numero de moles constantes, su volumen varia en razón directa con la temperatura absoluta, osea, que si la temperatura se duplica a presión y numero de moles constantes, el volumen se duplica y si la temperatura se reduce a la mitad el volumen se reduce a la mitad y la relación anterior se conoce como la ley de charles.

Condiciones de un gas ideal: Un gas es aquel que se encuentra a una presión de una atmósfera que ocupa p=1atm t=273 k 1mol

LEY DE AVOGADRO: La Ley de Avogadro es una ley de los gases que relaciona el volumen y la cantidad de gas a presión y temperaturas constantes. El volumen (V) es directamente proporcional a la cantidad de partículas de gas (n)
ejemplo: se dan 0,5 moles de un gas que ocupan 2 litros. Calcular cual será el nuevo volumen si se añade 1 mol de gas a presión y temperaturas constantes.
- V1 / n1 = V2 / n2
- V1 = 2 litros
- n1 = 0,5 moles
- n2 = 0,5 + 1 = 1,5 moles
LEY DE LOS GASES IDEALES: La ecuación pv=NRT se conoce como la ley de los gases ideales donde p=1atm v=22,4 n=1mol r es la constante universal de los gases
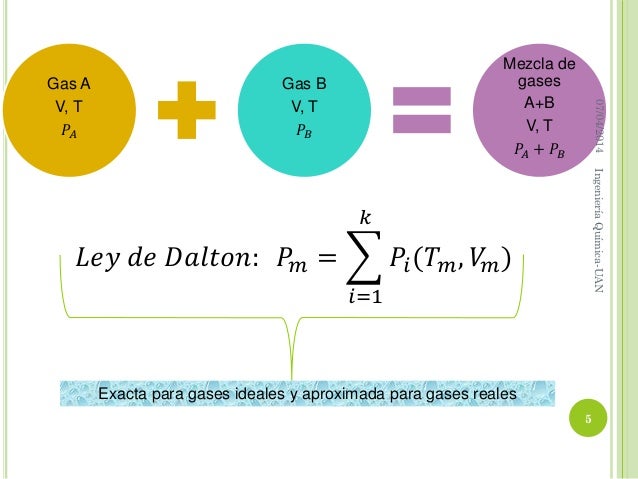
LEY DE DALTON: Dalton encontró que una mezcla de gases a temperatura y volúmenes definidos, la presión total es igual a la suma de las presiones parciales, esto significa que cada gas ejerce una presión. A la mezcla igual a la que ejercería si estuviese solo en el mismo volumen.
No hay comentarios:
Publicar un comentario